 |
| Sumber : wikipedia (mimin malas ngegambar di paint) |
Dulu mimin pernah ngebahas soal konfigurasi elektron untuk golongan A. Nah, itu adalah cara menuliskan konfigurasi elektron dengan cara kulit. Sekarang, kita bakal menuliskan konfigurasi elektron suatu atom dengan sistem spdf. Apa itu spdf? Kok keren gitu namanya yah kayak mimin? spdf adalah simbol untuk macam-macam subkulit dengan s = sharp, p = principle, d = diffuse, dan f = fundamental. Masing-masing subkulit memiliki batas maksimum untuk diisi elektron serta memiliki jumlah orbital yang berbeda.
s memiliki 1 orbital dan maksimal hanya boleh diisi 2 elektron
p memiliki 3 orbital dan maksimal hanya boleh diisi 6 elektron
d memiliki 5 orbital dan maksimal hanya boleh diisi 10 elektron
f memiliki 7 orbital dan maksimal hanya boleh diisi 14 elektron
Nah, sekarang yang menjadi pertanyaan, gimana sih caranya buat bikin konfigurasi elektronnya? Perhatikan gambar yang mimin copas dari wikipedia berikut.
 |
| Sumber : wikipedia (mimin malas ngegambar di paint) |
Contoh pertama mimin akan menggunakan atom Belerang (S). Atom belerang memiliki nomor atom 16 maka otomatis jumlah elektronnya juga 16. Sehingga konfigurasi elektronnya bisa kita tulis sebagai berikut
Nah, perhatikan konfigurasi elektron tersebut. Sulfur atau belerang jumlah elektronnya 16. Pertama kita tulis dulu 1s. Karena s maksimal boleh diisi dengan 2 elektron, maka kita tulis "2" di kanan atasnya. Sekarang, elektronnya tersisa 16 - 2 = 14, maka masih harus kita tulis lagi subkulit berikutnya yakni 2s. Tentu saja s hanya bisa diisi 2 elektron, maka kita tulis lagi "2" di atasnya. Berikutnya masih tersisa 14 - 2 = 12 elektron, sehingga kita harus menuliskan subkulit berikutnya yakni 2p. p dapat diisi 6 elektron, maka kita tulis 6 diatasnya. Begitu seterusnya hingga pada subkulit 3p tersisa 4 elektron. Maka, kita tulis 4 di kanan atasnya. Karena elektronya sudah habis, maka selesailah penulisan konfigurasi elektronnya, horeee.
Baiklah, biar tambah paham lagi, mimin bakal kasih contoh yang kedua yakni menggunakan atom rubidium (Rb) sebagai contoh. Nah, atom rubidium memilki nomor atom 37 maka otomatis jumlah elektronnya 37. Sehingga penulisan konfigurasi elektronnya.
Dengan melihat penjelasan yang pertama, ente pasti bisa mengerti cara membuat konfigurasi elektronnya, kan? Nah, konfigurasi elektronnya juga bisa diurutkan kayak gini nih biar keliatan
Nah, kayak gini kan enak bulat diliat. Mimin tambahain deh contoh ketiga biar ente-ente semua bisa faham. Kalo tadi kayaknya contohnya adalah unsur golongan A semua, sekarang mimin bakal kasih contoh yang dari unsur golongan B. Mimin akan menggunakan unsur Iridium (Ir) sebagai contoh. Iridium bernomor atom 77 maka konfigurasi elektronnya adalah sebagai berikut.
Nah, udah paham kan? Untuk mengetes apakah ente paham sama penjelasan mimin. Coba dong cari konfigurasi elektron dari unsur berikut ini. Pasti bisa deh.
-Rhodium (Rh), nomor atom = 45
-Besi (Fe), nomor atom = 26
-Galium (Ga), nomor atom = 31
Bagi yang bisa silahkan komen ^_^ Bagi yang nggak ngerti atau ada masukan silahkan komen juga. Oh yah, mimin juga bakal kasih tau cara menyingkat konfigurasi elektron dengan menggunakan simbol unsur gas mulia di postingan berikut. Eh, tapi sebelumnya mimin harus kasih tau kalo ternyata ada pengecualian dalam asas afbau. Apakah pengecualiannya itu? Misterius bukan? Yang pasti kalo ente mencari konfigurasi elektron dari unsur Kromium (Cr) sama sebangsanya dengan cara yang mimin jelaskan tadi pastinya bakal salah. Makanya tunggu episode berikutnya hanya di KNK Blog. To Be Continued . .. ....
Jangan lupa juga
Sandal sering ilang? Baca tips ini dan beli baru
Baca fakta yang belum tentu ente tau disini
Sering dikatain garing? Makanya tobatlah dan berhentilah ngelawak






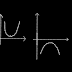





Good, saya bisa(dalam artian: ngerti ngerti pusing)
ReplyDeleteHahaha =D
Delete